1: Visão geral

O Ferro é um elemento que na natureza pode apresentar mais de uma forma. Esta variação é chamada de Alotropia, do grego allos; que significa outros e tropos; que significa maneira. Portanto, do ponto de vista químico, alotropia é a capacidade de um mesmo elemento químico apresentar-se em configurações estruturais diferentes. Estas configurações se diferenciam, entre si, pela forma como os átomos do elemento se unem, criando redes ou formatos diferentes.
Logo, a existência de diferentes configurações resultam em diferentes Estruturas (ou Arranjos) Cristalinas. Estruturas Cristalinas referem-se ao comportamento espacial e microscópico apresentado pelos elementos, chamados de cristais, que é resultante de uma organização em nível atômico e; portanto, microscópico. Essa organização microscópica, em nível atômico, é repetida e a menor parcela representativa desta organização é conhecida como Célula Unitária.
Então, conforme haja organizações atômicas diferentes, nós também teremos, Células Unitárias igualmente distintas. O conjunto de Células Unitárias distintas resulta igualmente em distintas Estruturas Cristalinas. Estas estruturas são representadas através de sólidos geométricos, demonstrando, desta forma, o arranjo atômico particular de cada Célula Unitária. Assim, para o Ferro duas configurações ou Estruturas Cristalinas são mais representativas: CCC e CFC.

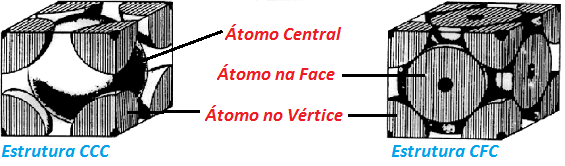
CCC – Cúbico de Corpo Centrado: Como o nome diz, é uma estrutura representada por um cubo, com átomo centrado. É aquela onde o átomo, neste caso o Ferro, apresenta-se ao centro de um cubo e este é rodeado por outros átomos que apresentam a mesma configuração estrutural de cristal.
Estes átomos vizinhos que circundam o átomo central apresentam-se no vértice do cubo, dispendendo 1/8 de seu volume total em cada nova Célula Unitária. Sendo assim, 8 átomos (número de vértices de um cubo) com o tamanho de 1/8, ao serem somados resultam, de forma equivalente a um átomo de Ferro, que ao ser somado ao átomo central forma uma célula com 2 átomos.

CFC – Cúbico de Face Centrada: Da mesma forma como a Estrutura CCC esta é representada por um cubo, mas seus átomos estão dispostos na face e nos vértices do cubo, simultaneamente, ao contrário da Estrutura CCC que está disposta apenas nos vértices. Os átomos vizinhos apresentam-se no vértice do cubo, dispendendo 1/8 de seu volume total em cada nova Célula Unitária. Sendo assim, 8 átomos (número de vértices de um cubo) com o tamanho de 1/8, ao serem somados resultam, de forma equivalente a um átomo de Ferro. Possuem ainda mais 6 vizinhos, dispostos nas faces (um cubo possui 6 faces), onde cada um apresenta 1/2 de seu volume. Assim, totalizam, nas faces 3 átomos que somados ao resultado dos átomos do vértice (1 átomo no total) resultam em 4 átomos para cada Célula Unitária.
Essas diferenças resultam importantes para a Ciência dos Materiais e para um Projeto adequado. Para melhor entender e facilitar a compreensão alguns parâmetros foram criados para que seja possível uma análise matemática o que torna mais intuitiva a percepção.
Célula Unitária: É a menor parcela representativa do arranjo atômico, feito através de sólidos geométricos.
Número de Coordenação (N): É o número total de átomos vizinhos. O número de átomos vizinhos considera os átomos “inteiros” e aqueles que apresentam parcelas ou frações de átomos. Isso permite identificar o número de Células Unitárias adjacentes (vizinhas) que se relacionam entre si.
Volume do Átomo (Va): É o volume de TODOS os átomos presentes na Célula Unitária. Como estimativa adota-se que o átomo é uma esfera perfeita; logo, o Volume do átomo é calculado a partir do Volume da esfera, onde o raio desta é o próprio Raio Atômico do elemento.
Volume da Célula Unitária (Vc): É o volume da Célula, que por sua vez é representada através de um sólido geométrico. Para o caso de Estruturas Cristalinas Cúbicas, caso do CCC e CFC, o Volume da Célula Unitária é o Volume do Cubo, onde a aresta é determinada em função do Raio Atômico, sendo chamada de Parâmetro de Rede.
Parâmetro de Rede (a): É a medida da aresta do cubo em função do Raio Atômico, o que facilita cálculos e comparações.
Fator de Empacotamento (F. E.): Índice muito importante já que é a relação entre o Volume Total dos átomos (Va) com o Volume da Célula Unitária (Vc). Isso permite identificar o quanto de compacto (ou denso) é uma Célula Unitária e sua correspondente Estrutura Cristalina. Também permite afirmar quanto do volume da Célula Unitária é utilizada pelos átomos e quanto de “espaço vazio” existe na Célula Unitária.
Com esses parâmetros é possível comparar Estruturas Cristalinas, seus respectivos arranjos e as suas correspondentes características, tais como propriedades mecânicas, térmicas, termodinâmicas, elétricas ou magnéticas. Por exemplo, o Ferro de tipo CCC é magnético e quando CFC é não magnético.
2: Comparação entre as Estruturas CCC e CFC
Nossa próxima etapa de estudo é, a partir de alguns parâmetros de relevância realizar a comparação entre as Estruturas Cristalinas CCC e CFC. Os parâmetros selecionados para nosso estudo são:
- Número de átomos
- Número de Coordenação (N)
- Parâmetro de Rede (a)
- Volume da Célula Unitária (VC)
- Volume do Átomo (Va)
- Fator de Empacotamento (FE)
2.1: Número de átomos
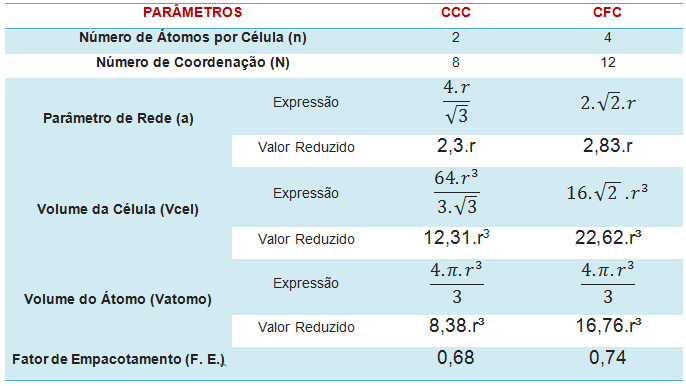
– CCC: Possui Célula Unitária na forma Cúbica, com 1 átomo central e 8 partes de átomo em seus vértices. Isso totaliza 2 átomos por Célula Unitária.
Cálculo: 1 átomo + ( 1/8) átomo x 8 (vértices do cubo) = 2 átomos
– CFC: Possui Célula Unitária na forma Cúbica, com frações de átomo nas faces e 8 partes de átomo em seus vértices.
Cálculo: (1/2) x 6 (faces do cubo) + ( 1/8) x 8 (vértices do cubo) = 4 átomos
22: Número de Coordenação (N)
– CCC: O átomo Central é rodeado por 8 frações; portanto, possui 8 Células Unitárias vizinhas, sendo esse o Número de Coordenação.
– CFC: Um átomo é rodeado por 12 frações; portanto, possui 12 Células Unitárias vizinhas, sendo esse o Número de Coordenação. Realizando a contagem de átomos, percebe-se que existem 14 vizinhos, mas dois átomos (metade) tomados da face constituem 1 átomo inteiro, o que resulta nos seus 12 vizinhos.
– CCC: Valor que relaciona a aresta do cubo (a) com o Raio atômico.
2.3: Parâmetro de Rede (a)
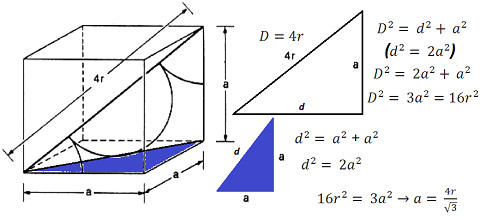
O valor do Parâmetro de Rede é a própria aresta do cubo. Para realizar este cálculo é necessário buscar pontos que assumam entre si uma relação. Para o caso da Estrutura CCC, essa relação se dá pela diagonal do cubo. A diagonal do cubo vale 4r, uma vez que ele comporta 1 Célula Unitária (átomo central), tendo; portanto, a medida de um Diâmetro, o mesmo que o raio duas vezes. Nos vértices existe uma fração de átomo cujo tamanho equivale a 1 raio, sendo duas as frações existentes, somando-se com os 2 raios do átomo central, totalizam-se 4 raios. O triângulo retângulo que contém a diagonal do cubo possui ainda, como altura a aresta ‘a’ do cubo, que é o próprio Parâmetro de Rede. A base desse triângulo retângulo é a diagonal de outro triângulo retângulo que é o triângulo retângulo da base do cubo, cuja relação com ‘a’ é transpassada para o triângulo retângulo maior, onde está a diagonal do cubo. É importante notar que o cubo, em si, possui duas diagonais: A diagonal do cubo, que é aquela que atravessa o sólido de vértice a vértice e a diagonal da face ou da base. A expressão resultante deduzida equivale a a = 2,3r.
– CFC: Valor que relaciona a aresta do cubo (a) com o Raio atômico.
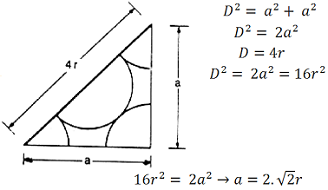
O valor do Parâmetro de Rede é assim como para a Estrutura CCC, a própria aresta do cubo. O cálculo em si é mais simples; pois, não necessita de uma análise espacial, mas sim uma simples análise planar. Os pontos que encontram relação entre si estão presentes na face do cubo. As arestas do cubo conformam os catetos de ângulo reto no triângulo retângulo e estas arestas, representadas pela letra ‘a’ é o próprio Parâmetro de Rede . A diagonal desse triângulo retângulo é a relação do raio. Essa medida é constituída pelos 2 raios das frações de átomos presentes nos vértices. Estes somados com os 2 raios do átomo (metade do átomo) presente na face, totalizam 4 raios. A expressão resultante deduzida equivale a a = 2,83r.
Observa-se que o valor de Parâmetro de Rede da Estrutura Cristalina CFC é maior que o valor da Estrutura CCC. Isso é muito importante; pois:
A capacidade de solubilização do CARBONO na estrutura atômica do Ferro é função direta da “abertura” que a Estrutura Cristalina do Ferro oferece à entrada do átomo de Carbono. Logo Estruturas CFC apresentam maior capacidade de solubilizar (reter) Carbono do que Estruturas de tipo CCC.
Nós pudemos explicar isso a partir do conhecimento das Estruturas Cristalinas. Muito pode ser dito a partir dessa linha de raciocínio.
2.4: Volume da Célula Unitária (Vc)
É o volume do cubo – V = a³.
– CCC: Substituindo o valor de ‘a’ tem-se:
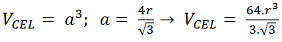
Isso equivale a: 12,31 R³.
– CFC: Substituindo o valor de ‘a’ tem-se:
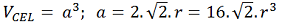
Isso equivale a: 22,62 R³.
Nós podemos observar que o Volume da Célula Unitária com Estrutura Cristalina CFC é maior que o Volume da Célula Unitária com Estrutura CCC. Isso já era esperado, uma vez que o Volume da Célula Unitária é feito através do Parâmetro de Rede e este é maior para a Estrutura CFC; logo, o Volume da Célula Unitária também é maior.
2.5: Volume do Átomo (Va)
É o volume da esfera, considerando a totalidade de átomos presentes na Célula Unitária. O volume da esfera é dado como segue:
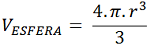
Substituindo o valor de ‘a’ tem-se que o Volume para 1 Átomo apenas é 4,19 r³, o que é válido para o CCC e o CFC. Para um cálculo efetivo, o número de átomos deve ser considerado.
Assim, para o CCC, têm-se 2 átomos e para o CFC têm-se 4 átomos. Desta forma o Volume de Átomo para uma Célula Unitária de Estrutura Cristalina de tipo CCC vale 8,38 r³.
Para o CFC, têm-se 4 átomos; logo, o Volume de Átomo para uma Célula Unitária de Estrutura Cristalina de tipo CFC vale 16,76 r³.
2.6: Fator de Empacotamento (FE)
É a relação entre o Volume total de átomos na Célula Unitária pelo Volume da Célula Unitária. Informa o quanto a Célula Unitária é preenchida de átomos. Os valores extremos são 0, quando não há presença de átomos na Célula Unitária e 1 quando o Volume e ocupação dos átomos preenche por completo a Célula Unitária. Assim, para valores maiores maior é a presença ou ocupação dos átomos na Célula Unitária, para valores mais baixos, menor é a presença ou ocupação dos átomos na Célula Unitária.
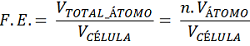
– CCC: Substituindo os valores, lembrando que n = 2 (2 átomos por Célula Unitária) tem-se:
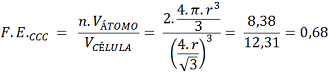
– CFC: Realizando procedimento semelhante e substituindo os valores, sendo n = 4 (4 átomos por Célula Unitária) tem-se:
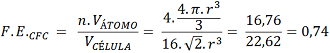
Como já esperado, o valor para CFC foi maior que CCC, uma vez que a quantidade de átomos é maior (CFC = 4 átomos e CCC = 2 átomos). Esses parâmetros apresentados explicam muitas aparentes controvérsias no comportamento dos materiais, além de poderem ser usados na prática do dia-a-dia do profissional de engenharia.
2.7: Exemplo
Determinar a variação no Volume do Ferro quando ocorre transformação de CFC para CCC. Considerar o Raio atômico constante.
Solução: A variação ocorre entre as Células Unitárias, o que faz comparar o Parâmetro de Rede entre elas. Para tanto, antes deve ser feito um balanço de massa atômica, já que para cada Célula Unitária de Estrutura CCC, nós temos 2 átomos e no caso da Estrutura CFC, o número é 4; portanto, o Volume da Célula Unitária da Estrutura CCC deve ser multiplicada por 2, mantendo assim, a constância da massa atômica. Assim sendo, temos:
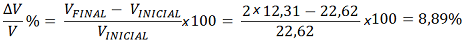
O valor informa que houve uma expansão de Volume. Isso ocorre porque mesmo que o Volume de Célula Unitária do CCC seja menor, ela comporta apenas 2 átomos quando o balanço é realizado, o volume da Célula Unitária do CCC se torna maior que do CFC.
3: Tabela Resumo

Pingback: Princípios da Ciência dos Materiais - FVNUNES ENGENHARIA